マイシグナル
【2024年ノーベル賞受賞】遺伝子調節役を担う「マイクロRNA」
- 公開日: 11/28/2024
- |
- 最終更新日: 11/28/2024

2024年のノーベル医学・生理学賞を受賞した「マイクロRNA」の研究をご紹介します。
マイクロRNAは、従来のセントラルドグマでは説明できない生命の精密な調節機構として機能し、がんなど様々な疾患の理解に新たな視点をもたらしています。治療応用には課題が残るものの、早期診断分野では大きな可能性を秘めており、日本が世界に先駆けて実用化を進めています。
本記事ではマイクロRNAについて、専門知識がなくても理解できるようわかりやすく解説します。
目次
講師紹介
市川裕樹(Ph.D.)Craif株式会社 最高技術責任者(CTO)
名古屋大学 未来社会創造機構 客員准教授。東京大学大学院 薬学系研究科にてケミカルバイオロジーを専攻し博士号(薬学)を取得。研究活動に並行してGlobal Healthのプロジェクトにも従事。幼少期をオランダで過ごした海外経験と技術バックグラウンドを活かし、米国のNPOにてザンビア等の開発途上国への医療テクノロジー導入も支援。大学院修了後、2013年にバイエル薬品に入社。オンコロジーや眼科領域事業でMR、マーケティングの経験を積んだ後、経営企画や全社プロジェクトのPMO等、幅広い業務をリードした。 同社を退職後、2019年1月Craif株式会社に参画。

\早期発見の難しいすい臓がんも対象/
「尿」で10種のがんリスクを判定!
マイシグナル・スキャン
日本のがん死亡数の約8割を占める10種類のがん※を個別にリスク判定します。尿中のマイクロRNAをAI解析技術が評価され、すでに全国2000軒の医療機関でも導入されています。
- ※国立がん研究センターがん情報サービス「がん統計」(厚生労働省人口動態統計)、ただし造血器腫瘍を除く
ノーベル賞を受賞した「マイクロRNA」
2024年度のノーベル医学・生理学賞は、アメリカの科学者であるビクター・アンブロス氏とゲイリー・ラブカン氏が、「マイクロRNAの発見とその遺伝子調節における役割」の功績により共同受賞しました。
「マイクロRNA」は我々の事業とも関連の深いトピックであるため、コンセプトや内容についてお話できたらと思います。
理系のバックグラウンドのない方にも、分かりやすく聞いていただけるような内容になればと思っております。もちろんバイオの知識がある方でも、興味を持ってもらえるような形でお話しします。
「マイクロRNA」は、日本が世界に先駆けて実用化に踏み出している領域でもあるため、そういった取り組みについても紹介いたします。
2024年のノーベル医学・生理学賞はマイクロRNAの研究者が受賞

2024年ノーベル生理学・医学賞は2人のマイクロRNAの研究者が受賞しました。左のビクター・アンブロス教授と、右のゲイリー・ラブカン教授です。
受賞理由は、「マイクロRNAと遺伝子調節における役割の解明」というところで、マイクロRNAを発見したことが、評価に非常に大きな功績があると認められました。
マイクロRNAとは?遺伝子の基礎について
「マイクロRNA」とは何か、というところを解説します。簡潔にまとめると、RNAは以下の特徴を持っています。
| 特徴 | 概要 |
| とても短いRNA | 22〜25個の「塩基」という小さなパーツからできたRNAで、よく知られているDNAやメッセンジャーRNAと比較しても極めて小さい物質 |
| 遺伝子の調節役 | 遺伝子が発現する過程で作用し、細胞がいつどのようなタンパク質を作るかをコントロールする役割 |
| 生物の仕組みや病気も関係 | 体の発達や再生、免疫の働きなど、さまざまな場面で細胞が正しく機能するための役割を担い、がんなどの疾患とも深く関連している |
これだけだと今日の講師も必要がなくなってしまいますので、もう少しかみ砕いて解説します。マイクロRNAの実態をつかむ前に、ベースとなるDNA・RNA・遺伝子の基礎について、簡単にご紹介します。
遺伝子はどこにある?
「遺伝子」について、名前はもちろん皆さん聞いたことあると思います。体の設計図だったり、遺伝情報を持っていたりと、いろいろな言葉で聞いたことがあるかもしれません。
遺伝子って何?どこにあるの?というところからスタートしたいと思います。はじめに、遺伝子について紐解いていきましょう。
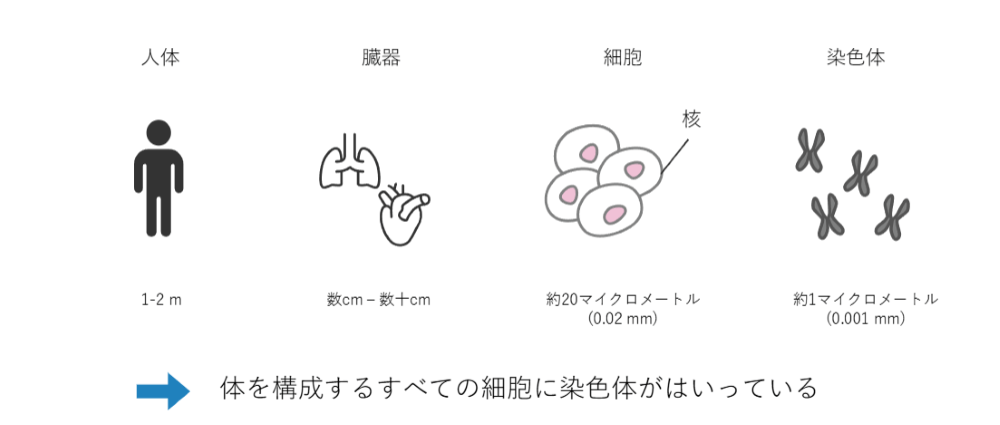
まず、我々の身体は心臓・肺・筋肉・肝臓など、さまざまな臓器からできていて、臓器は全て細胞からできています。細胞の中には核と呼ばれるものがあり、その中には「染色体」という物質が入っています。皆さんも言葉としては聞いたことがあるかと思います。
体を構成する全ての細胞の中には、染色体というものが入っています。
染色体とは?
染色体というのは、非常に長いDNAが折りたたまれてできた物質です。我々の体は1,2メートルあり、各臓器がおよそ数センチから数十センチ程度です。細胞はおよそ20マイクロメートルくらいで、染色体はさらにそこから20分の1くらい細かいものになっています。
この染色体を紐解いてみると、ものすごく長い「DNA」という紐状の物質が折りたたまれています。すべて伸ばすと大体2メートルくらいのDNAが、これだけ小さい細胞の中に入っていると言われています。
DNAとは?
「DNA」に関しても、名前は聞いたことがあると思います。DNAについて概要を簡単にお話しすると、A・C・G・Tと4つの記号で表される4種類の物質が、長く鎖状につながった物質です。
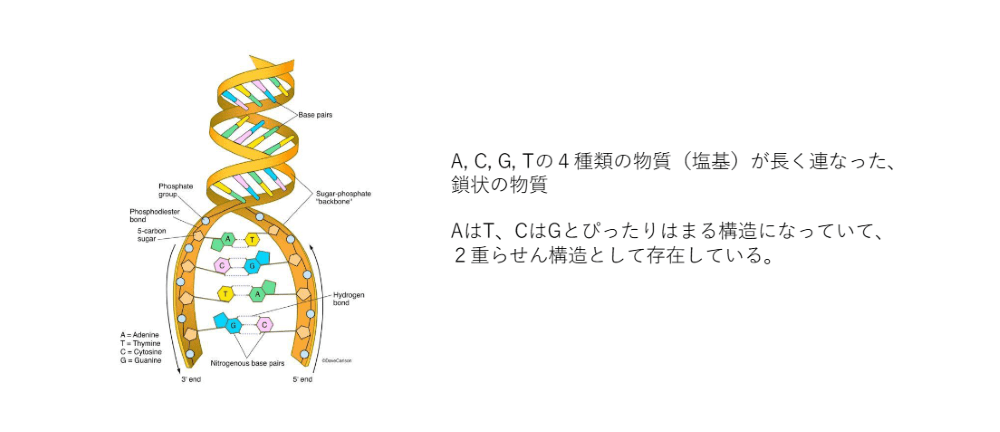
図に模式的に書いてあるように、AとT、CとGがぴったりとはまるようになっています。AとT、CとGの組み合わせがぴったりとはまることによって、二重螺旋構造として体の中に存在しています。この二重螺旋の形でぐるぐると折りたたまれたものが、染色体として存在しているのです。DNAというのは、紐状の物質だということをご認識いただければと思います。
DNAを設計図としてタンパク質がつくられる
もう一つ重要なポイントは、このA・T・C・Gという記号で表されるものが、相補的にぴったりくっつくことで独立遺伝情報として機能しているということです。
細かい内容についてお話しすると1学期分くらいになってしまうので、本日はこちらの図で少しでもイメージをつかんでいただけたらと思います。
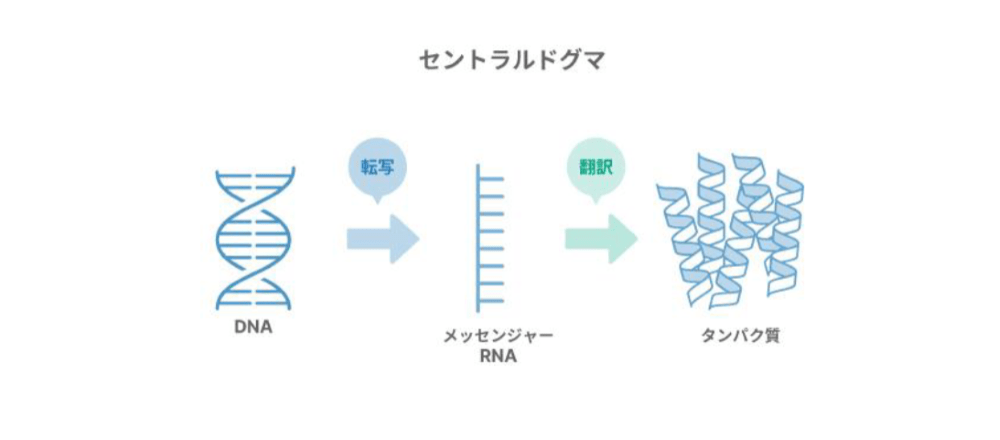
このDNAがどのように体の設計図として機能しているかということです。「DNA」が「メッセンジャーRNA」に一度変わった後、タンパク質を作ります。「DNAを設計図としてタンパク質が作られる」ということが、DNAが遺伝子として体の設計図として認識されている理由です。
食品にも入っているタンパク質ですが、体の中では以下のようなさまざまなものがタンパク質からできています。
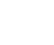
- 筋肉
- 皮膚
- 酵素
- ホルモン
- 免疫
- ヘモグロビン
これらのタンパク質は、DNAの情報が読み取られることでつくられています。この遺伝子の情報に基づいて、酵素やホルモンを作ることがプログラムされています。それがタンパク質になることによって、我々の体が機能を果たすようになっています。
もう少しだけ詳しくみていきましょう。DNAはAとT、CとGがそれぞれペアになって二重螺旋の構造で非常に長く連なっています。
タンパク質を作る際は、二重螺旋の構造からコピーされ、メッセンジャーRNAとして一本鎖のものが一度作られることになります。そして、このメッセンジャーRNAの配列に応じたアミノ酸がどんどんくっつくことによって、タンパク質が合成されます。
そのため、遺伝子からタンパク質が作られる流れである「セントラルドグマ」では、DNAの配列情報が一時的にコピーされ、その情報に基づいて対応するタンパク質が作られる流れがベースの仕組みです。
ゲノム・遺伝子・DNAの違い
ゲノム・DNA・遺伝子など、似たような言葉は皆さん聞いたことあると思います。

ゲノムはATGCの流れ全体のことを指しています。2メートルあるDNA配列で、何がどのように連なっているかという情報全体をゲノムといいます。このATGCは、約60億個連なっているといわれています。
次に遺伝子について、こちらも耳なじみのある言葉かと思います。遺伝子はゲノム全体のうち、タンパク質の設計図になっている部分を指します。図でいうと、長いゲノム全体の情報のうち、一部赤で示された部分だけがタンパク質として読み取られるとなった場合、この部分を遺伝子と呼んでいます。
60億個の文字列情報の中で約数万箇所ほど遺伝子と呼ばれる部分があり、それぞれが別々のタンパク質をプログラムしています。その数万個のタンパク質が機能することで、体は成り立っています。
遺伝子1つあたり、赤で示したゲノム1個1個が大体数万塩基続いていると言われています。これも大小さまざまですが、大体1万から1万5千塩基程度だと言われています。さらに、ゲノム全体のうち、遺伝子の情報があるのはわずか1,2%程度だと言われています。そのため図の黒の部分はあまり機能しておらず、ゲノムの一部だけがタンパク質を作るという機能を果たしています。
そして最後にDNAについてですが、DNAは物質そのものです。先ほど細胞の中に細かく折りたたまれたDNAが入っていると申し上げましたが、DNAはこの物質自体のことを指しています。
ゲノム・遺伝子・DNAの違いについて混同しやすいですが、こういった違いがあるということを頭の片隅に入れていただければと思います。
ゲノムの大部分は本当に機能していないのか?
疑問として、これだけたくさんのDNAが連なってゲノムがあるにもかかわらず、機能している場所は本当に一部なのかと言われていました。これには、それ以外の部分に本当に役割がないのかどうかが十分にわかっていなかったという背景があります。
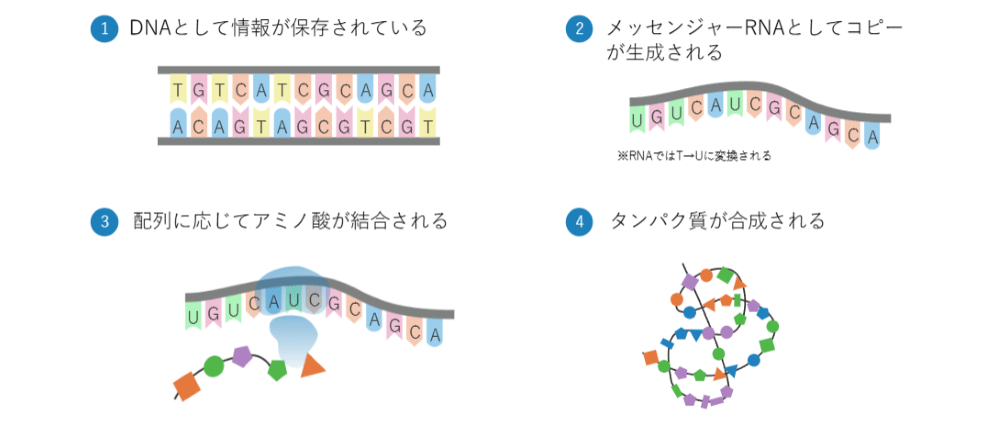
しかし、その一部として、元々ゴミだと思われていたような領域の中から、実は「マイクロRNA」という重要な機能を果たしているものがあるということがわかってきました。
先ほど、各遺伝子は大体1万塩基程度続いているとお伝えしましたが、マイクロRNAは大体20塩基から25塩基くらいまでです。なので、塩基数としては本当に短いですが、非常に重要な機能を果たしていると考えられています。
いろいろお話ししましたが、一番大事なセントラルドグマの流れだけ簡単に頭の中に入れておいていただければと思います。
DNAという設計図から一時的にコピーされ、メッセンジャーRNAという物質になります。次に、その情報を基にタンパク質が合成されて、このタンパク質があらゆる機能を果たしている。このような流れが大まかな体の成り立ちです。
遺伝子研究の歴史
次に、本題のマイクロRNAについてお話を進めていきます。まずは、歴史の方から紐解いていきましょう。
遺伝子の研究は1940年代から80年代まで、この時期に限らずですが、急速に発達してきました。
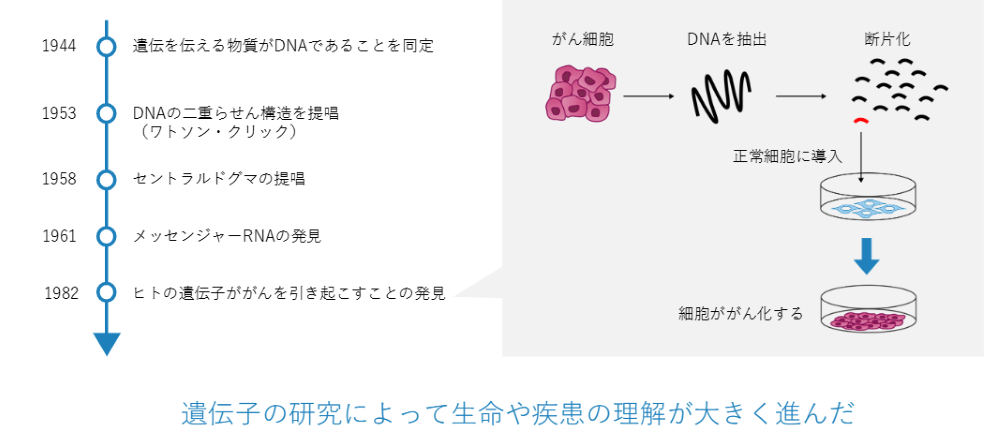
| 1800年代の終わり | メンデルが色々な形質は遺伝するという「メンデルの法則」を発表 |
| 1944年 | 遺伝情報を伝えている物質がDNAであることが同定された |
| 1953年 | ワトソン・クリックにより、DNAが二重螺旋構造になっていることが提唱された |
| 1958年 | DNAがタンパク質になるセントラルドグマという流れがあるということが提唱された |
| 1961年 | メッセンジャーRNAの存在が発見された |
| 1982年 | ガンが遺伝子の病気であることが突き止められた |
このような遺伝子の研究によって、生命科学の分野で病気についてどんどんわかってきました。これだけ複雑な身体の仕組みを、物質がどのように形作っているのかがわかってきました。
ノーベル賞を受賞したマイクロRNAの研究内容
そのなかで、ノーベル賞を受賞したラブカン教授とアンブロス教授の研究について見ていきましょう。彼らも遺伝子の研究を進めている研究者です。彼らはモデルとして線虫を使って、どの遺伝子がどのような機能を持っているのかを研究しているなかで、面白い個体がいることを見つけました。
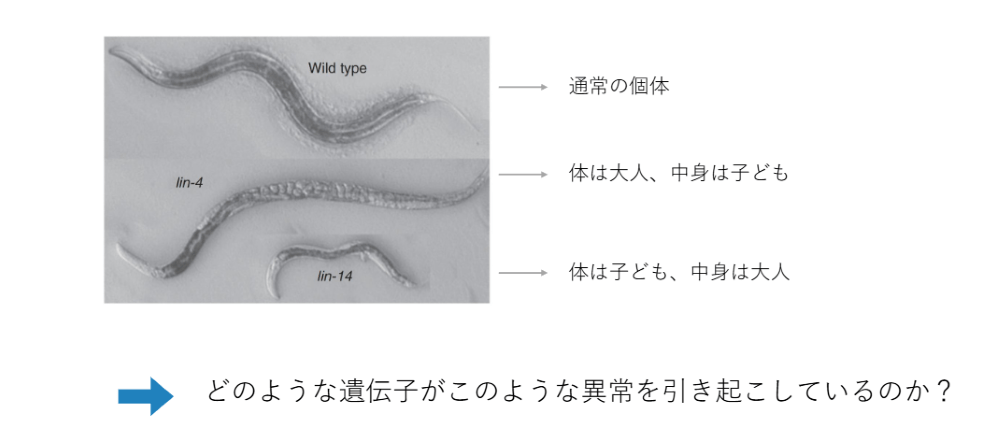
一部に、体は大きくても体の中の器官が全然育っていない、中身が子供のままのような個体がいました。逆に、体自体が大きくなる前に中身が大人になってしまう個体がいることを見つけました。
とくに図の真ん中の個体は、卵を産むことができません。そのため、体の中にどんどん卵が溜まっていってしまいます。このように、一部に異常な個体があるということを2人の研究者は見出しました。そして、どういった遺伝子がこのような異常を引き起こすのかという研究を開始しました。
異常な成長に関わる2つの遺伝子を同定
研究の結果、lin-14とlin-4の2つの遺伝子が、重要な働きをしていることを発見しました。
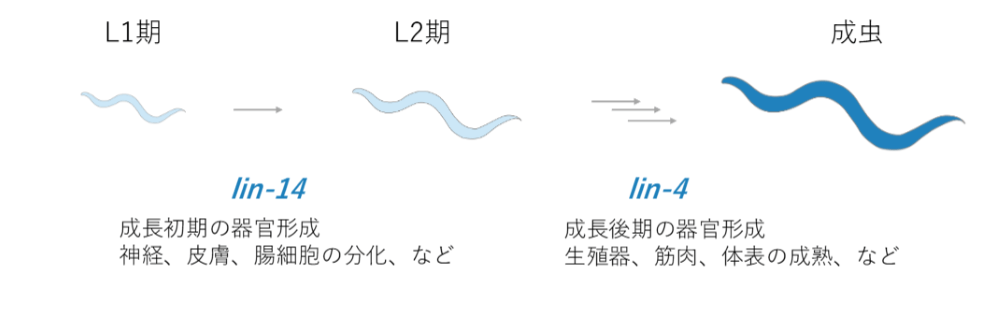
lin-14は、成長初期の器官形成、神経や皮膚、腸などを作っていくということが分かりました。一方lin-4は、生殖器や筋肉などの形成を担う成長後期の器官形成に関わります。
ここから少し複雑になりますが、lin-4の体内での働きについて説明します。lin-4が出てくるとlin-14を阻害します。lin-4が出てきてlin-14が機能しなくなることによって、後期の変化が進んでいくということがわかりました。
つまりlin-14は直接機能してこの成長初期の器官形成が進んでいきますが、lin-4はlin-14を止めることで、成長が初期から後期へシフトチェンジすることが分かりました。
先ほどの異常な個体をもう少し紐解きます。ここも少し複雑になるので、頭の片隅で考えていただければと思います。
lin-14の方に異常があった場合を考えましょう。この場合は、正常な初期の器官形成が進みません。lin-14がないため、成長後期の成熟が始まってしまいます。これが起こると、子どものまま、中が成熟した個体ができてしまいます。
逆にlin-4に異常がある場合は、lin-4は働かないためlin-14がずっと機能したままになってしまいます。そのため、後期の成長が起こらず、初期の成長がずっと続いたままになってしまいます。結果的に、大人の成熟として必要な生殖器などができないまま、身体だけ大きくなる個体ができることがわかっています。
セントラルドグマとの矛盾が生じる
ここまではよくある遺伝子研究でしたが、大きな謎がありました。lin-14は遺伝子のDNAがあって、lin-14のタンパク質が見つかっていました。一方で、lin-4の方はどれだけ探してもタンパク質が見つからず、遺伝子にしてはあまりにも短すぎることがわかりました。
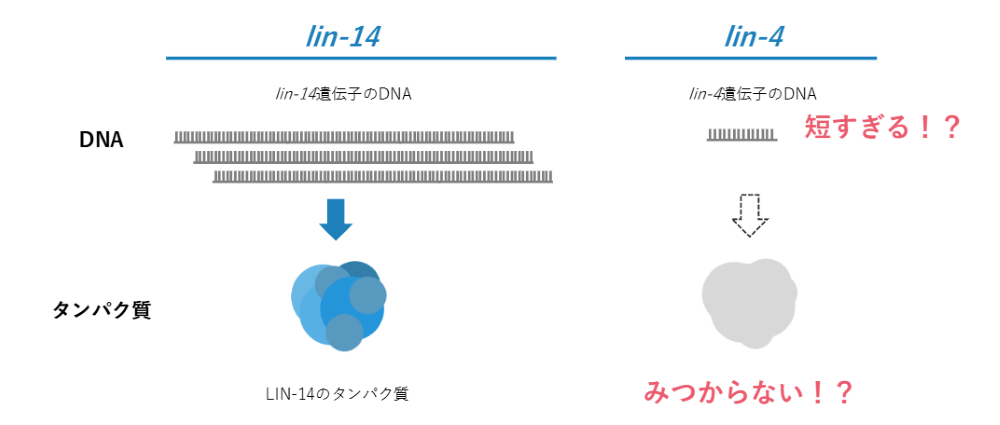
先ほど、1遺伝子あたり数万塩基くらいあるとご説明しました。しかし、lin-4の機能を果たしているのは、わずか数百塩基程度の短い領域であることがわかったのです。
これは何なのかということが、この研究の大きな疑問としてあがりました。
先ほど説明したセントラルドグマの流れでいうと、自分たちが解き明かしてきた生命の基本原理はセントラルドグマでいろいろ説明ができるはずでした。しかし、遺伝子として機能するにはあまりにも短すぎるDNAと、見つからないタンパク質というものがありました。では、どうやってこのlin-4がlin-14を阻害しているのか、というところを調べていきました。
RNA段階での相互作用でタンパク質合成を阻害
ここでカギになるのは、「メッセンジャーRNA」です。DNA・RNA・タンパク質の各段階のうちRNAがカギだということがわかりました。
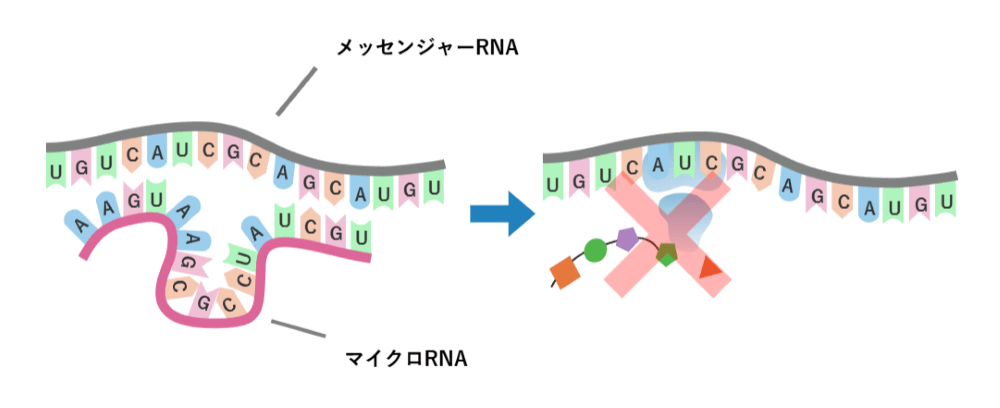
lin-4の短いRNAができたとき、このRNAがlin-14のメッセンジャーRNAとくっつくことで、その先のタンパク質の合成が進まなくなることが研究でわかりました。つまりlin-14とlin-4はRNAの段階で相互作用することで、正常な身体の機能が起こることを突き止めたことが、2人の研究者の大きな成果になりました。のちに、この小さなRNAは「マイクロRNA」と名付けられ、30年の時を経てノーベル賞に輝くといった成果になっています。
マイクロRNAによる調節はヒトを含むすべての生物に共通している
マイクロRNAの何がすごいのかについて、次にご紹介したいと思います。ノーベル賞受賞のもうひとつの大きな理由についてです。
先ほどの例があるのは線虫だけで、他の生物種には応用できないと思われていました。ラブカン教授のインタビューでは「ほかの生物にも当てはまるとは思っていなかった」というような発言もされています。
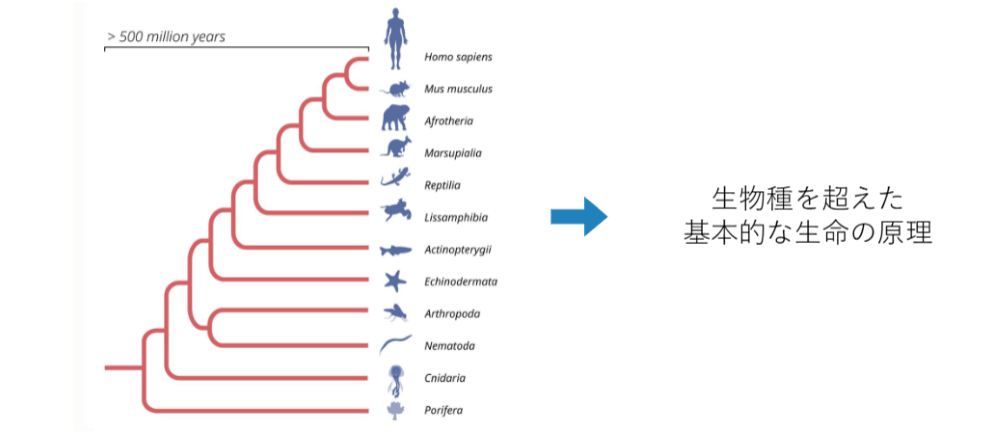
2000年に、こういったRNAの一種が線虫だけではなく、あらゆる生物種で共通して見られるとわかりました。とくに、その中でもRed7というようなものは、この論文では取り上げられています。
マイクロRNAは、いろいろな生物種で共通した仕組みとして持っていることがわかりました。セントラルドグマの一連の流れだけではなく、マイクロRNAを使って遺伝子発現を調節することが生物の基本的な構成原理となっていることを解明したのが、評価を高めた要因となっています。
そのため、このような遺伝子研究を進めていくことによって、これまでとは違ったかたちで働いている興味深いRNAを見つけたということが、彼らの大きな成果になりました。
マイクロRNAによる詳細な遺伝子の調節機構が判明
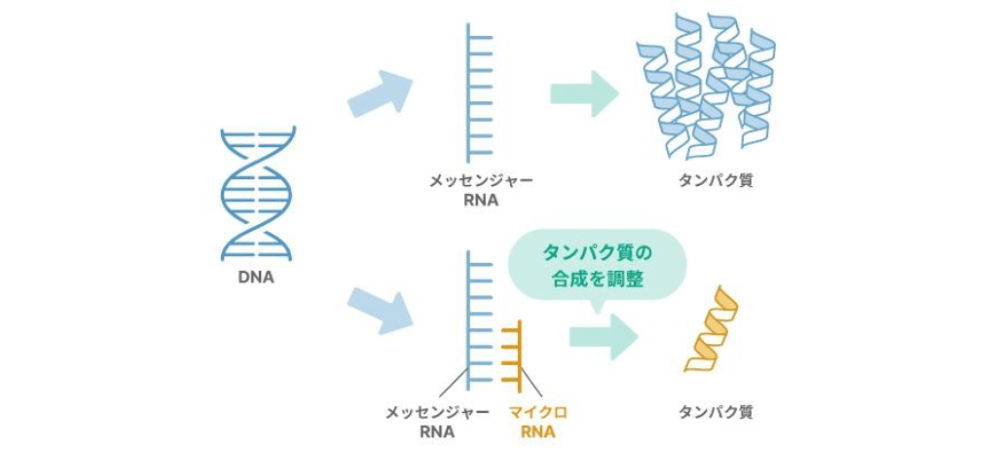
簡単に図にまとめると、いわゆる古典的なセントラルドグマでは、DNAがメッセンジャーRNAに変わって、それがタンパク質に変わっていきます。一方で、マイクロRNAという新しいものが見つかると、もう少し理解が複雑になってきます。
DNAがメッセンジャーRNAになる段階で、マイクロRNAがメッセンジャーRNAを調節することによって、タンパク質が作られなかったなど。そういった形で色々な調節機構が働いているということがわかるようになってきました。それが、マイクロRNAがセントラルドグマの中で果たしている役割であるといえます。
なぜマイクロRNAは重要なのか?
がんの原因は、たとえば放射線やタバコ、当時流行っていたウイルス性のがんなどです。がんの原因は何かという研究は進んでいて、精力的に調べられてきました。最終的には、人の異常化したがん細胞の遺伝子を普通の細胞に入れると、普通の細胞ががん化するということを解き明かしました。
遺伝子の解明により、がんの疾患のメカニズムが明らかに
つまり、遺伝子をみることでがんという病気を解明できる、という機運がどんどん高まっていきました。がんが遺伝子の病気だとわかってからは、遺伝子の研究というかたちで進んでいきました。がんの遺伝子の研究が進んでいくと、がんのメカニズムがより詳細にわかってきます。
ひとつの遺伝子研究の成果の例を挙げます。がん細胞というのはどんどん増殖が止まらなくなってしまう細胞です。たとえば、遺伝子でコードされ機能しているタンパク質であるEGFRです。これは細胞が増えるべきタイミングになるとEGFが増加して、それと結合することで増殖シグナルが分泌され細胞が増殖する分子です。
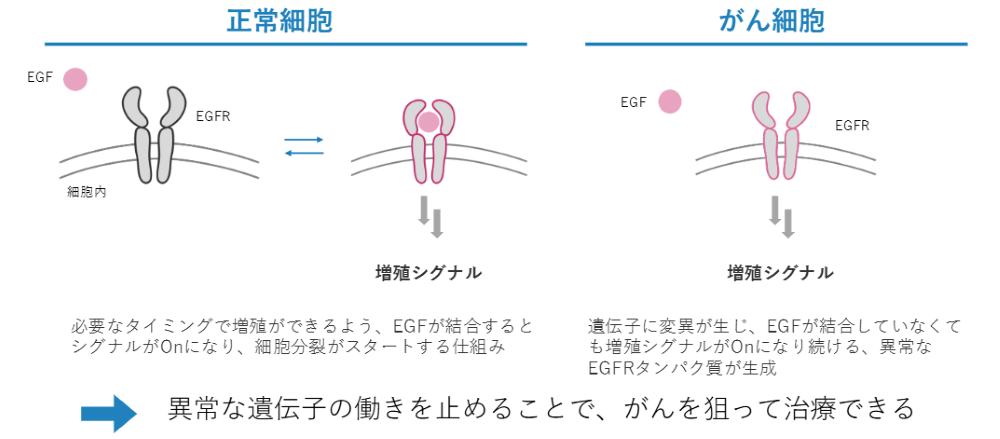
普通の細胞であれば、このようにEGFとEGFRが結合することで、増殖するという流れが起こります。しかし、がん細胞ではEGFRの遺伝子に変異が入り、EGFRと結合しなくても増殖シグナルが出て、細胞がEGFRの異常によってどんどん増殖してしまいます。つまり、異常な遺伝子を見つけられたら、がんを狙って治療できるのではないかと考えています。
遺伝子の研究によりがんの治療が変わる
実際にそういったものをベースに研究をしていくと、これまでの抗がん剤ではかなり広範囲の細胞を傷つけてしまうようなものでしたが、がんの原因となる遺伝子やタンパク質を狙うことで、がん細胞だけを狙えるような薬が作れるのではないかと考えられ、分子標的薬と呼ばれる薬がつくられるようになってきました。
これにより、たとえば白血病などの治療成績はものすごくよくなりました。以来、ものすごく多くの分子標的薬がつくられるようになりました。
遺伝子のことがわかってくるとがんの仕組みがわかり、それに対する治療薬がどんどん作られるようになっています。それに伴って、がんへの医療の考え方も変わりました。
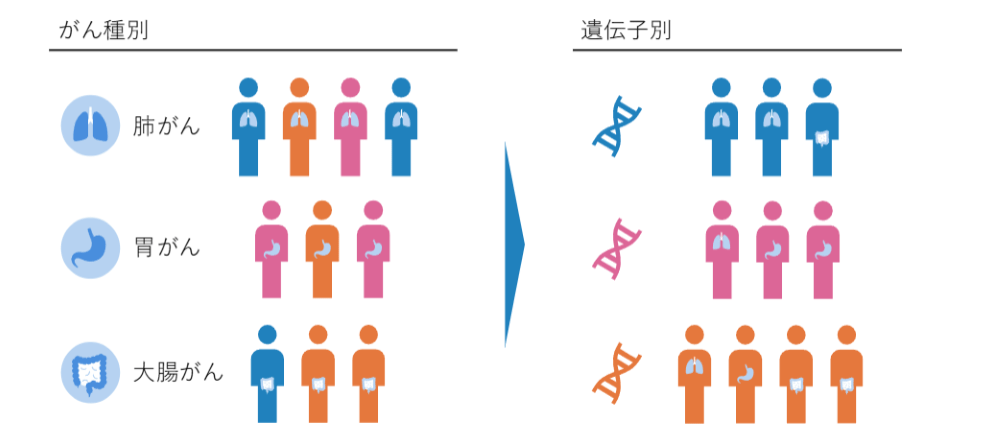
それまでは肺がんは肺がんの先生、胃がんは胃がんの先生、大腸がんは大腸がんの先生といった臓器別の考え方の中心だったのが、臓器だけではなく遺伝子別の考え方も進んできました。
がんの原因である遺伝子にどのような異常があるのかを見る、という考え方です。たとえば、肺がんの人と大腸がんの人で同じ薬が使えるのではないかなど、いろいろな考え方が発展しました。
がんの治療は改善しているものの課題も残っている
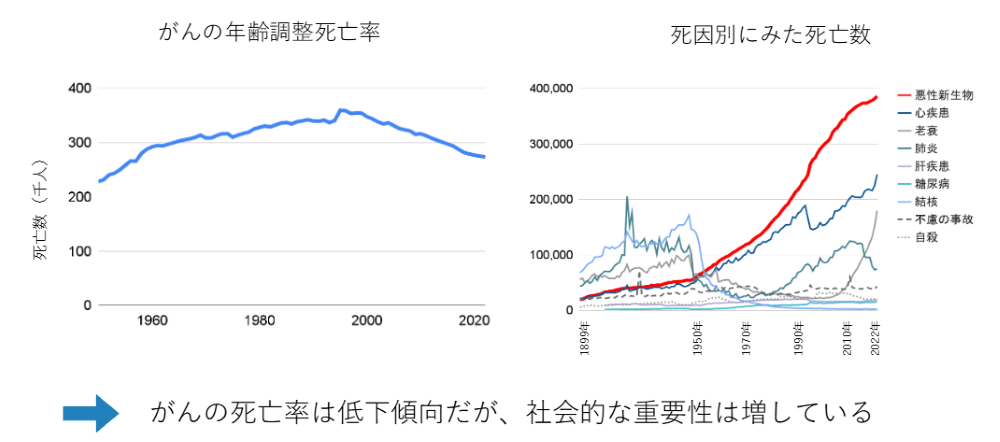
がんの死亡率についての表をみてみると、2000年までずっと上がってきた死亡率が、研究の成果が花開いて2000年以降は徐々に死亡率が下がってきており、一定の成果を見ることはできています。
ただ、「がんを克服できたか」という問いに対して、イエスと答える人はあまりいないのが現状です。死因別にみた死亡数をみてみると、がんはかなり長い間死因の第一位を占めており、増加傾向が続いています。
がんになるには色々な原因がありますが、そう簡単に克服できる病気ではありません。その背景を簡単にまとめると、がんの遺伝子研究ではたくさんの成果が得られています。がんの多様性に理解がすすんだり、遺伝子情報に応じてがんを分類したり、それに合わせて治療法を開発したりといった功績です。一方で、がんについてまだまだ分かっていないことはたくさんあります。
たとえば、「遺伝子のスイッチ」というものです。同じ異常な遺伝子があったとしても、それが機能するときと機能しないときはどのように使い分けられているのか。遺伝子をたくさん調べることで、色々な情報がわかってきます。しかし、どの遺伝子ががんを引き起こしているのか、どの遺伝子変異ががんによって引き起こされているかなどの区別はまだ難しいのが現状です。
遺伝子を見ているだけではがんの全容をつかむことは難しいのではないかと考えています。がんのやっかいなところは、ステージが進んで転移してしまって、元々は肺がんだったのに、脳など様々な臓器に転移して悪くなってしまうところです。最初は効いていたはずの抗がん剤が徐々に効かなくなってしまうなど、がんの進化がやっかいなところです。
しかし、そこに対する知見はまだあまり深まっていません。遺伝子研究で成し遂げたものもあれば、なお残っている課題も多いというのが現状です。
マイクロRNAに関する研究の実例
「マイクロRNA」が貢献するのは実はここで、残っている課題にいくつかの解をもたらすだろうという考えがあります。
簡単にマイクロRNAに関する研究の例を2つご紹介します。
マイクロRNAは乳がんの浸潤や転移に関わっている
乳がんの浸潤や転移に関して、マイクロRNAが深く関わっているということがわかってきました。
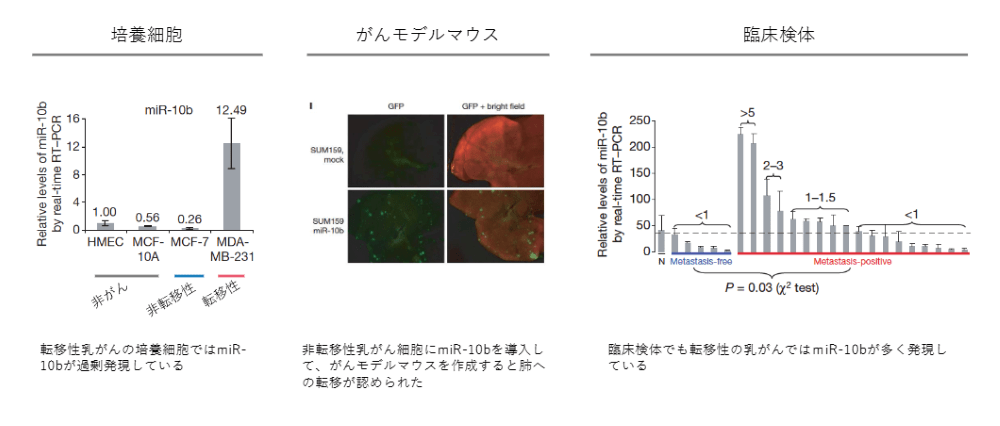
左図の細胞株で、転移しない乳がんと転移する乳がんを比較すると、miR-10Bは転移する乳がんだけで高く上がっています。転移しないがん細胞をmiR-10Bをたくさん放出するように変えると、普通なら肺に転移しなかったがんが、肺にたくさん転移がみられるようになりました。
実際の臨床のサンプルでも、転移している人に関してはマイクロRNAの量が多いということがわかってきました。これにより、マイクロRNAががんの転移を引き起こしているのではないかということがわかりました。
マイクロRNAは薬剤耐性に関わっている
別の例で言うと、マイクロRNAは薬剤が効かなくなる「薬剤耐性」に非常に深く関与しているのではないかと考えています。
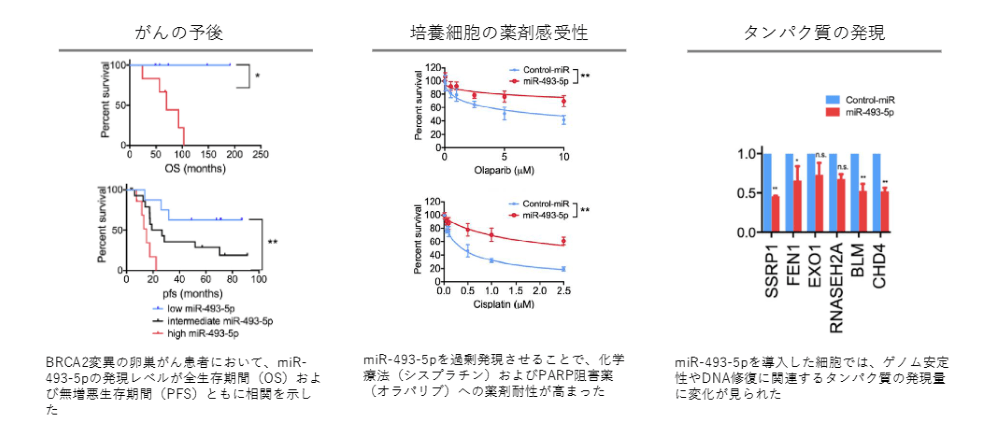
がんの予後をみたときに、miR-493-5pに着目しました。
miR-493-5pが多いがんの患者は予後が悪く、比較的すぐに亡くなってしまいます。一方、miR-493-5pがあまりないがんの患者は予後が良いことが分かりました。
また、培養細胞に抗がん剤をかけて、どれだけの濃度をかけたらがん細胞が死滅するかという実験でも、miR-493-5pを投与すると、薬剤に対して感受性が悪くなることが確認されています。実際にmiR-493-5pを投与すると、DNAの修復やゲノムの安定性にかかわるタンパク質の発現量が変わってくることがわかりました。
このような知見から、がんの転移や薬剤耐性の獲得など、がんの複雑さにマイクロRNAが深く関与していることがわかりました。
先ほど申し上げた「セントラルドグマ」は、今まで思っていた以上により複雑な調整機構が働いているだけじゃなく、その調整機構こそが疾患の複雑さの原因になっているということがわかったことが重要です。
マイクロRNAの臨床への応用
最後に、マイクロRNAを応用した話をいたします。マイクロRNAには、2つの応用の可能性があります。

マイクロRNAを利用した疾患の治療
治療現場でも、マイクロRNAはがんをはじめとした様々な疾患と関わっていることが知られています。
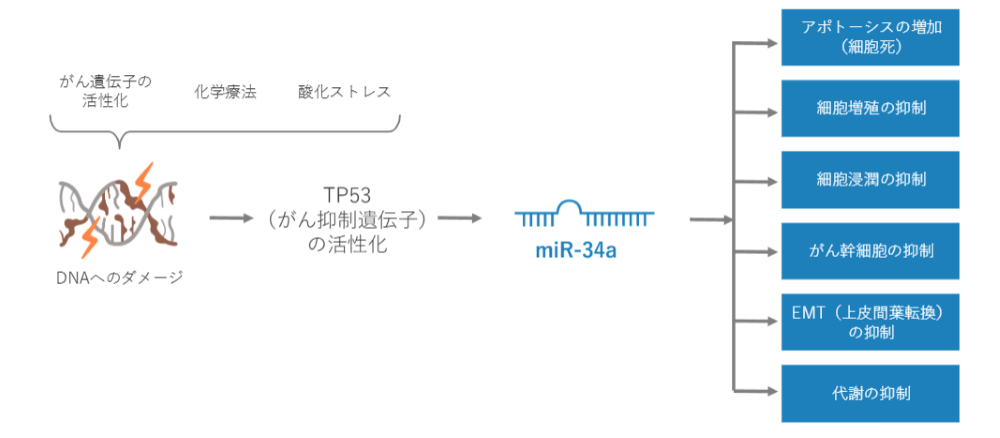
たとえば、DNAの変異でがんになったりとか、化学療法、がん治療をしたりとか。酸化ストレスでDNAにダメージがかかると、miR-34aが増えます。miR-34aにがんを止める働きがあることはよく知られています。miR-34aにがんを止める働きがあるのであれば、miR-34aを投与すれば抗がん剤になるのではないかという発想がでてきます。
様々な臨床試験は行われていて、たとえば今説明したmiR-34aも臨床試験は行われています。しかし、残念ながらこの臨床試験はなかなかうまく進んでいないのが現状です。
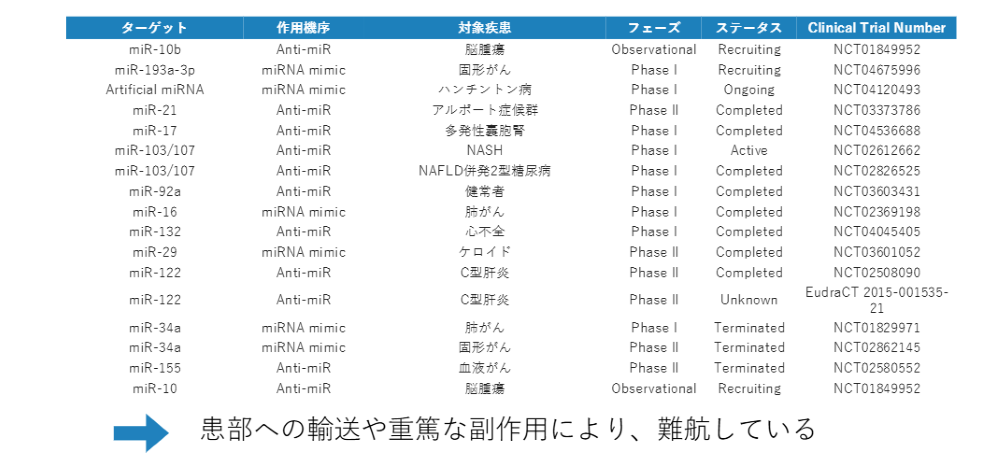
こちらは、マイクロRNAを利用した治療法開発の進捗状況をまとめた資料です。残念ながら、フェーズ3まで進んでいるものは皆無の状況です。マイクロRNAをどうやって患部に届けるかなど、難しい課題がいくつかあります。
また、miR-34aに関しては、非常に残念ながら重篤な副作用によって5,6名が亡くなってしまい、臨床試験が中止になってしまいました。miR-34aに関しては、多くの役割を果たしているがゆえに、投与してしまうと思いもよらない副作用が起こるなど、様々な問題が発生し、研究は思うように進んでいません。
マイクロRNAを利用した疾患の早期診断
一方で、がんの早期診断に関しては、マイクロRNAは有用であると考えられています。DNAとマイクロRNAの疾患のなかでの役割の対比について考えていきましょう。
がんの原因はDNAに変異が生じることです。その結果として、がん細胞はマイクロRNAを活用しはじめ、色々な悪さをしたり、転移していったりしていきます。
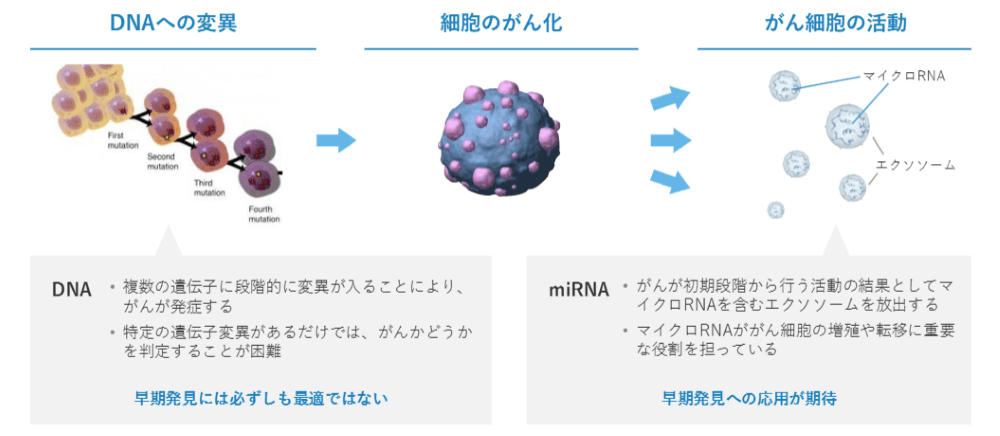
がんは、DNAの色々な部分に転移が起きて、閾値を超えて初めて発症します。そのためDNAに変異があるからといって必ずしもがんであるとは限りません。一方で、マイクロRNAはがんの活動を直接的に表していると知られています。
DNAとマイクロRNAの違いをみていくと、DNAではなかなか発見できなかった早期のがんに対してもマイクロRNAを使ったら検出できるのではないかと考えました。
マイクロRNAを利用したがんの早期発見
マイクロRNAによるがんの早期発見については、我々は非常に長い期間取り組んでいます。技術的なハードルはいくつかあります。
マイクロRNAは非常に微小な分子であるため定量するのが難しかったり、量が多いわけではないので安定して測ることが難しかったりといった課題です。それに対し、我々はバイオマーカーであるマイクロRNAをどのように捉えていくかに焦点をあてました。
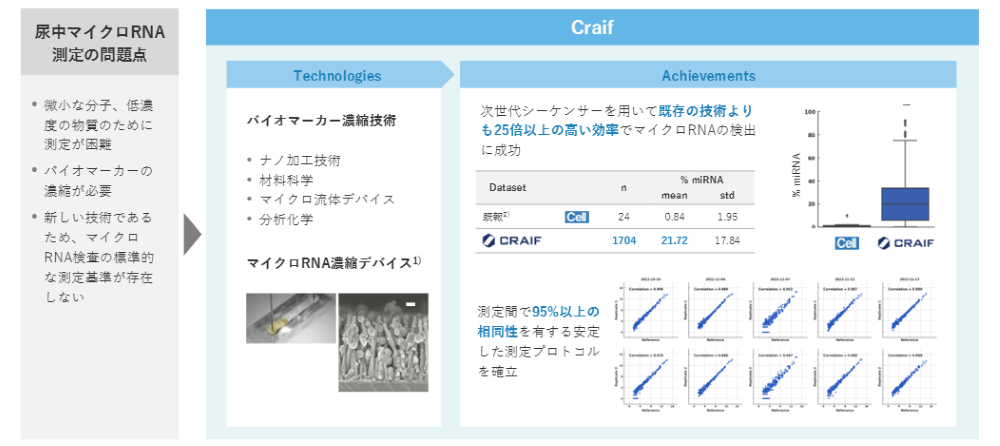
Craifでは、ナノ加工技術やマイクロ流体デバイスを使って、マイクロRNAを高濃度に検出する技術を確立し、これまでよりも効率よくマイクロRNAを測れるようになりました。
マイクロRNAはがんの早期発見に非常に効果的で、このデータでいうと10種類のガンに対して、初期段階も含めて非常に好感度に検出できるというデータが出ています。つまり、マイクロRNAをうまく捉えて測定することさえできれば、早期発見につながるということが分かってきています。
尿中マイクロRNAを測定する「マイシグナル・スキャン」

我々は「マイシグナル・スキャン」という、尿中のマイクロRNAを測定してがんのリスクを検査するキットを展開しています。
マイシグナル・スキャンが何を測定しているかご説明します。がんの方と健常者の方の尿中マイクロRNAのパターンを、それぞれAIで解析しています。がんの方には疾患に関連したマイクロRNAが非常に多く発現しているということがわかっています。この違いを学習させることによって、「健常」か「がん」かということを判定することに成功しました。
がん種によって発現しているマイクロRNAのパターンは異なるので、1回の尿検査で7種類のがんを検査できます。
現在は、マイクロRNAの発見から30年くらい経っていて、実用化につながるタイミングになりました。我々Craifもそうですが、日本はマイクロRNA研究において、世界をリードしているような領域になっています。
基礎研究や実用化に関しても、ぜひ日本から世界を引っ張っていきたいと考えています。
\早期発見の難しいすい臓がんも対象/
「尿」で10種のがんリスクを判定!
マイシグナル・スキャン
日本のがん死亡数の約8割を占める10種類のがん※を個別にリスク判定します。尿中のマイクロRNAをAI解析技術が評価され、すでに全国2000軒の医療機関でも導入されています。
- ※国立がん研究センターがん情報サービス「がん統計」(厚生労働省人口動態統計)、ただし造血器腫瘍を除く
この記事をシェア
この記事の監修者

名古屋大学 未来社会創造機構 客員准教授、博士(薬学)、薬剤師
東京大学大学院 薬学系研究科にてケミカルバイオロジーを専攻し博士号(薬学)を取得。研究活動に並行してGlobal Healthのプロジェクトにも従事。幼少期をオランダで過ごした海外経験と技術バックグラウンドを活かし、米国のNPOにてザンビア等の開発途上国への医療テクノロジー導入も支援。大学院修了後、2013年にバイエル薬品に入社。オンコロジーや眼科領域事業でMR、マーケティングの経験を積んだ後、経営企画や全社プロジェクトのPMO等、幅広い業務をリードした。 同社を退職後、2019年1月Craif株式会社に参画。
カテゴリから探す
キーワードから探す






